Щелочные вещества — это химические соединения, которые имеют высокую щелочную активность. Они обладают способностью образовывать ион гидроксида (OH-) в растворах. Щелочные вещества характеризуются высокой щелочностью и могут реагировать со многими кислотами, образуя соль и воду.
Главным свойством щелочных веществ является их способность нейтрализовать кислоты. Когда к щелочной веществу добавляется кислота, происходит реакция нейтрализации, в результате которой образуется соль и вода. Щелочные вещества также обладают высокой концентрацией гидроксидных ионов, что делает их отличными щелочными растворами.
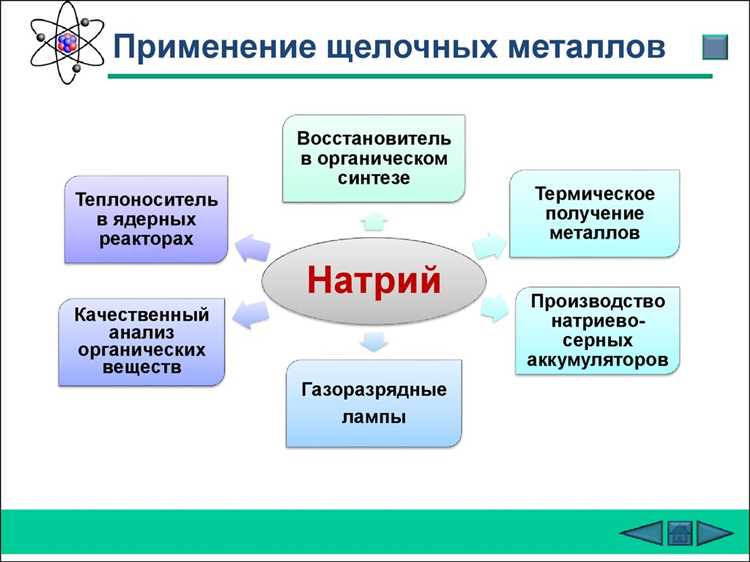
Применение щелочных веществ очень широко. Они используются в различных сферах: от бытовой химии до промышленности. Например, оксид натрия и гидроксид натрия находят применение в изготовлении стекла, мыла, моющих средств и многих других продуктов. В медицине щелочные вещества используются в качестве противоядия при отравлениях кислотами.
- Описание щелочных веществ
- Определение и классификация
- Описание щелочных веществ — важная тема в химии
- Физические свойства
- Щелочные вещества обладают рядом характерных физических свойств, таких как высокая плотность, точка плавления и кипения.
- Свойства щелочных веществ
- Щелочность и кислотность
- Одно из главных свойств щелочных веществ — их щелочность
- Химическая реактивность
Описание щелочных веществ
В природе щелочными веществами являются, например, гидроксиды натрия (NaOH), калия (KOH), аммония (NH4OH), которые получают из растительных и минеральных источников. Также многие щелочные вещества могут быть синтезированы и использованы в промышленности.
Примечание: Натрий гидроксид (NaOH), также известный как поваренная щелочь, широко используется в бытовых и промышленных целях. Он используется в качестве реагента в химической промышленности, а также в производстве зубных паст, моющих средств, бумаги и других продуктов.
Щелочные вещества обладают рядом свойств и применений. Они являются отличными основаниями, способными нейтрализовать кислоты. Также они могут быть используемы для регулирования pH-значения, в процессах очистки и дезинфекции, а также в производстве мыла и жирных кислот.
Определение и классификация
Щелочные вещества могут быть классифицированы по различным критериям. Одна из наиболее распространенных классификаций основана на химической структуре щелочных соединений. Согласно этой классификации, щелочные вещества могут быть разделены на две основные группы: гидроксиды и карбонаты.
Гидроксиды — это соединения, содержащие один атом гидроксильной группы (OH). Они образуются при реакции основного оксида с водой. Гидроксиды часто используются в промышленности, медицине и бытовых целях. Наиболее известные гидроксиды включают гидроксид натрия (NaOH), гидроксид калия (KOH) и гидроксид аммония (NH4OH).
Карбонаты — это соединения, содержащие группу карбоната (CO3). Они получают методом нейтрализации кислоты углекислым газом или путем взаимодействия металлического оксида с угольной кислотой. Карбонаты нашли применение в различных отраслях, таких как стекольная, керамическая и строительная промышленность. Карбонаты, популярные в промышленности, включают карбонат натрия (Na2CO3) и карбонат кальция (CaCO3).
Определение и классификация щелочных веществ позволяют более точно понять их свойства и применение в различных отраслях науки и промышленности.
Описание щелочных веществ — важная тема в химии
| Свойство | Описание |
|---|---|
| Реактивность | Щелочные вещества обладают высокой реактивностью и активно взаимодействуют с другими веществами. Они способны образовывать соли, воду и протоны в реакциях с кислотами. |
| Растворимость | Многие щелочные вещества растворяются в воде, образуя щелочные растворы. Растворимость щелочных веществ зависит от их химической формулы и структуры. |
| Химическая формула | Щелочные вещества имеют особую химическую формулу, которая содержит щелочной металл в качестве катиона и гидроксидную группу (-OH) в качестве аниона. Примерами щелочных веществ являются гидроксид натрия (NaOH) и гидроксид калия (KOH). |
Щелочные вещества широко применяются в различных отраслях промышленности и быта. Они используются в производстве мыла, стекла, моющих средств, бумаги, удобрений и других продуктов. Щелочные вещества также играют важную роль в химических лабораториях, где их используют в качестве реагентов для проведения различных химических реакций.
Физические свойства
Щелочные вещества обладают рядом характерных физических свойств, которые определяют их поведение в различных условиях.
- Точка плавления — большинство щелочных соединений обладают высокой точкой плавления, что обусловлено прочными химическими связями между атомами.
- Растворимость — щелочные вещества обычно хорошо растворяются в воде, при этом производят протолитическую реакцию, образуя гидроксиды щелочных металлов.
- Электропроводность — щелочные растворы обладают высокой электропроводностью, так как ионы гидроксидных групп свободно передвигаются в растворе.
Физические свойства щелочных веществ непосредственно влияют на их применение в различных отраслях промышленности, в том числе в производстве стекла, мыла, щелочных батарей и многих других.
Щелочные вещества обладают рядом характерных физических свойств, таких как высокая плотность, точка плавления и кипения.
Щелочные вещества, такие как гидроксиды и карбонаты металлов пониженных групп, образуют кристаллические твердые вещества с высокой плотностью. Это связано с тем, что в их структуре преобладает ионно-кристаллическая связь, что способствует компактной укладке ионных решеток. Благодаря этой особенности, щелочные вещества обладают большой плотностью и твердостью, что делает их полезными в различных промышленных и научных областях.
Они обычно имеют щелочную реакцию, то есть образуют растворы с щелочной средой.
Кроме того, многие щелочные вещества обладают высокой коррозионной активностью в контакте с влажным воздухом или водой. Они могут вызывать ожоги при контакте с кожей, поскольку при взаимодействии с водой образуются щелочные растворы. Щелочи обладают способностью дезинфицировать и разрушать органические материалы, поэтому они широко применяются в бытовой и промышленной сфере для очистки и обеззараживания поверхностей, канализационных систем и промышленного оборудования.
Свойства щелочных веществ
Щелочные вещества обладают рядом уникальных свойств, которые определяют их широкое применение в различных отраслях науки и промышленности.
Во-первых, щелочные вещества характеризуются высокой реактивностью. Они способны быстро взаимодействовать с различными веществами, особенно с кислотами. Благодаря этому свойству они часто используются в химических реакциях, например, в процессе нейтрализации кислот.
Во-вторых, щелочные вещества обладают высокой щелочностью. Они способны образовывать щелочные растворы, которые характеризуются высоким уровнем щелочности и обладают особыми свойствами. Это делает их неотъемлемой частью многих химических процессов, таких как мыловарение, производство стекла и промышленные очистные процессы.
Третьим важным свойством щелочных веществ является их способность образовывать соли. При взаимодействии с кислотами они образуют соли, которые являются основными компонентами многих химических соединений. Благодаря этому свойству соли, получаемые при реакции щелочных веществ с кислотами, широко используются в промышленности, медицине и пищевой промышленности.
Щелочные вещества также обладают амфотерными свойствами. Это означает, что они могут проявлять и кислотные, и основные свойства в зависимости от условий реакции. Благодаря этому свойству они могут использоваться в различных химических процессах, требующих образования как кислотных, так и щелочных соединений.
Наконец, щелочные вещества обладают высокой летучестью, что позволяет им быстро испаряться при нормальных условиях. Это свойство делает их ценными компонентами в производстве различных товаров, таких как мыло, моющие средства и дезинфицирующие средства.
Щелочность и кислотность
Как правило, щелочные вещества характеризуются высоким pH-значением, что означает, что они могут реагировать с кислотами и образовывать соли. Они обладают щелочным вкусом и оказывают щелочное действие на организмы и инструменты.
Щелочные вещества широко используются в различных сферах, включая бытовые и промышленные цели. Они являются основными ингредиентами в бытовых моющих средствах, таких как мыло и моющие порошки. Они также используются в производстве стекла, щелочных батарей, алюминиевых сплавов и других промышленных продуктов. Некоторые щелочные вещества применяются в медицине для регулирования кислотно-щелочного баланса в организме.
Щелочность и кислотность играют важную роль в химических реакциях и процессах. Они определяют множество свойств веществ и влияют на их разностороннее применение. Понимание этих свойств помогает в улучшении технологий и повседневной жизни, а также дает возможность построения успешных химических реакций и экспериментов.
| Свойства щелочных веществ: | Применение щелочных веществ: |
|---|---|
| Высокое pH-значение | Производство мыла |
| Щелочный вкус | Производство стекла |
| Щелочное действие | Изготовление щелочных батарей |
| Взаимодействие с кислотами | Производство алюминиевых сплавов |
Одно из главных свойств щелочных веществ — их щелочность
Щелочные вещества обладают способностью нейтрализовать кислоты, образуя с ними соли и воду. Это происходит благодаря их высокому уровню гидроксидных ионов (OH-) в растворе. Щелочность щелочных веществ способствует регулированию pH-уровня в различных системах, будь то химические процессы или биологические среды.
Одно из главных применений щелочных веществ — в бытовой химии. Натрий гидроксид (щелочь) используется в производстве моющих средств, отравляющих веществ, стиральных порошков и жидкостей для посудомоечных машин. Он обладает высокой эффективностью при удалении жиров, масел и других загрязнений. Кроме того, натрий гидроксид применяется в производстве бумаги, в текстильной промышленности и в процессе очистки и обработки металлов.
Еще одно важное свойство щелочных веществ — их растворимость в воде. Большинство щелочных соединений легко растворяются в воде, образуя щелочные растворы, которые могут быть использованы в различных отраслях промышленности. Например, гидроксид калия широко применяется в сельском хозяйстве в качестве удобрения, а также в фармацевтической и пищевой промышленности.
Щелочные вещества также обладают амфотерностью, то есть способностью выступать как в качестве щелочей, так и в качестве кислот. Примером является амфотерный оксид алюминия, который может реагировать как с кислотными, так и с щелочными растворами. Это свойство активно используется в процессе нейтрализации различных реакций и в качестве катализаторов в различных промышленных процессах.
И, наконец, десятничность — способность щелочных веществ образовывать кратные гидроксидные ионы (OH-). Это свойство позволяет им образовывать щелочной раствор с более высоким уровнем pH, что делает их эффективными ингредиентами в процессе регулирования pH-уровня в различных системах.
Химическая реактивность
Щелочные вещества обладают высокой химической реактивностью, что делает их важными компонентами в различных отраслях промышленности и науки.
Одним из основных свойств щелочных веществ является их способность растворяться в воде, образуя гидроксиды и основания. Гидроксиды щелочных металлов (например, натрия, калия, щелочные металлы) являются высокоосновными соединениями. Они обладают способностью принимать протоны (H+) и образовывать гидроксидные ионы (OH-), что делает их сильными основаниями. Такая реактивность щелочных гидроксидов делает их полезными в качестве щелочных растворов и открывает широкие возможности для их использования в различных химических процессах.
Кроме того, щелочные вещества могут образовывать соли с кислотами. Это обусловлено способностью щелочей принимать протоны от кислотных соединений и образовывать натрийные, калиевые или другие соли. Это свойство щелочных веществ широко используется в различных промышленных и научных процессах, а также при производстве различных продуктов, таких как моющие средства, стеклянная и керамическая продукция, фармацевтические продукты и т. д.
Некоторые щелочные вещества также обладают окислительными свойствами и способностью взаимодействовать с различными органическими и неорганическими соединениями. Они могут быть использованы в химических реакциях для окисления, нейтрализации или очистки различных веществ. Благодаря своей химической реактивности щелочные вещества играют важную роль во множестве химических процессов и находят широкое применение в различных отраслях промышленности и научных исследований.
В целом, химическая реактивность щелочных веществ является основой для их использования в различных процессах и обеспечивает им широкие возможности в различных областях. Изучение и понимание этого свойства щелочных веществ играет важную роль в развитии науки и промышленности и способствует созданию новых технологий и продуктов.